Questions fréquemment posées
Les vaccins autogènes représentent un complément précieux à la panoplie des vétérinaires. Ils offrent la possibilité d'être adaptés en fonction de l'évolution des agents pathogènes. Cette flexibilité confère une valeur ajoutée significative, en particulier lorsque les propriétés antigéniques des agents pathogènes évoluent au cours du temps. Les vaccins autogènes constituent un atout majeur pour la prévention des maladies infectieuses, la promotion du bien-être animal et de la sécurité alimentaire, ainsi que pour la réduction de la pression infectieuse, de l'usage d'antibiotiques et de la résistance aux antimicrobiens.
Le fondement juridique est établi par l'article 2, paragraphe 3, du Règlement (UE) 2019/6 :
« [...] les médicaments vétérinaires immunologiques inactivés, qui sont fabriqués à partir d'organismes pathogènes et d'antigènes isolés d'un animal ou d'animaux appartenant à une unité épidémiologique, et qui sont destinés au traitement de cet animal ou de ces animaux au sein de la même unité épidémiologique, ou au traitement d'un ou de plusieurs animaux d'un troupeau présentant un lien épidémiologique confirmé. »
Selon l'article 4, paragraphe 44, du Règlement (UE) 2019/6 et l'article 4, paragraphe 39, du Règlement (UE) 2016/429, une unité épidémiologique est définie comme un groupe d'animaux au sein duquel la probabilité d'exposition à un agent contagieux est considérée comme équivalente.
Le déplacement d'animaux entre différents sites ou exploitations d'élevage doit être pris en compte lors de l'établissement du lien épidémiologique. En conséquence, des animaux élevés sur des sites ou exploitations distincts géographiquement, mais présentant un lien épidémiologique, appartiennent à la même unité épidémiologique. Ceci s'applique principalement aux volailles et aux porcs dans le cadre des lignées parentales élevées en systèmes de production intégrée. Pour les animaux aquatiques, un lien épidémiologique existe également entre différentes exploitations ou sites au sein d'une même zone géographique, lorsqu'un agent pathogène identique est en circulation et se propage, par exemple, par des espèces aquatiques sauvages.
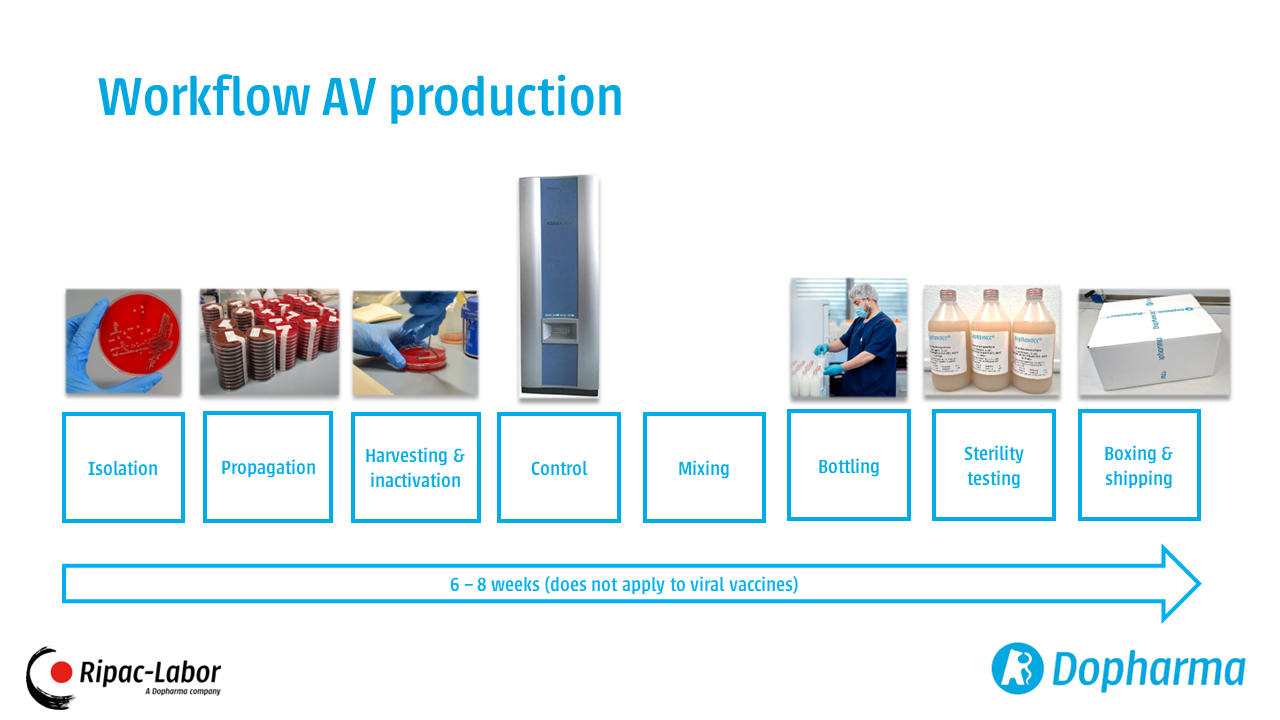
Conformément au Règlement (UE) 2019/6 (Considérant 70, Article 2, paragraphe 3, et Article 94), les médicaments vétérinaires immunologiques autogènes doivent être fabriqués conformément aux principes des bonnes pratiques de fabrication (BPF). Néanmoins, il n'existe pas encore de directives européennes BPF spécifiques à la production de vaccins autogènes. Dans l'attente de la publication de ces directives BPF pour les vaccins autogènes, conformément au Règlement (UE) 2019/6, Ripac-Labor produit ses vaccins en accord avec la législation allemande en vigueur et oriente sa fabrication et son assurance qualité sur les exigences spécifiées dans le document « Questions et Réponses » publié par l'Office central des Länder pour la protection de la santé concernant les médicaments et les dispositifs médicaux (ZLG Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten).
La production de Ripac-Labor, conforme aux BPF, est vérifiée par des inspections régulières de l'Office national pour la sécurité au travail, la protection des consommateurs et la santé (LAVG). De plus, Ripac-Labor a mis en place un système de gestion de la qualité afin de contrôler et de prouver en continu la qualité de ses processus et systèmes internes par le biais d'auto-inspections et de mesures complètes de contrôle qualité.
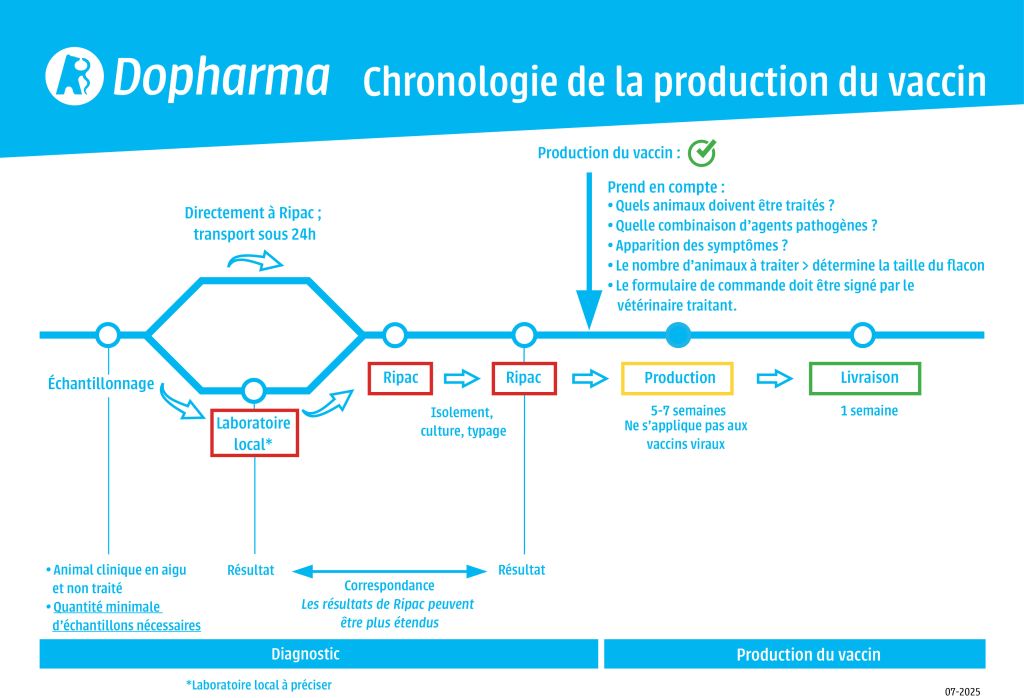
Il est important de ne prélever des échantillons que sur les animaux présentant des symptômes de maladie clinique aiguë. Ces animaux ne doivent pas avoir reçu de traitement antimicrobien depuis au moins une semaine avant le prélèvement. Le nombre d'échantillons requis varie en fonction de la maladie. Veuillez contacter votre équipe locale de support technique pour obtenir des recommandations spécifiques.
Demandez à votre laboratoire local d'envoyer un écouvillon contenant la culture pure dans un milieu de transport à l'adresse de Ripac-Labor :
RIPAC-LABOR GmbH
Am Mühlenberg 11
D-14476 Potsdam-Golm
Allemagne
Téléphone : +49 (0)331 5818400
Vous pouvez également adresser directement à Ripac-Labor des échantillons pour des services de diagnostic.
Vous pouvez accéder à la page de téléchargement regroupant tous ces documents via le pied de page ou en suivant ce lien.
RIPAC-LABOR est membre de l'EMAV, l'Association Européenne des Fabricants de Vaccins Autogènes et de Sérums. L'EMAV représente les principaux producteurs européens de vaccins autogènes et de sérums pour les animaux de production, de compagnie et les animaux exotiques. L'EMAV a publié un manuel contenant des recommandations pour la production et l'application des vaccins autogènes. Cette publication unique a été élaborée par des scientifiques reconnus issus d'universités vétérinaires européennes, des experts vétérinaires expérimentés et des spécialistes provenant des entreprises membres de l'EMAV.
Votre question n'est pas encore mentionnée ? Veuillez contactez-nous.